一、样品:
1、蛋白:浓度一般需大于200 ug/ml,要有活性,确保不含Tris、叠氮化纳等带有伯氨基团成分;
2、小分子:母液浓度建议大于10mM,体积50uL以上,纯度>90%,溶于100%DMSO里。如含有咪哗、蔗糖、甘油等高折光率物质,需进行脱盐处理。
二、开机:
1、启动电脑和仪器,Biacore X100 Plus的电源开关位于仪器右后侧下方。待主机面版上 TEMP 指示灯停止闪烁,即表示温度已稳定;
2、启动 Biacore X100 Control Software,登入;
3、待软件和主机建立连接,约 30 秒;
4、确认左侧缓冲液瓶已装入新鲜缓冲液且两根缓冲液管均插入瓶中;
5、确认右侧废液管已插入废液瓶中。
三、芯片的放置:
1、打开芯片室的门;
2、点击 Undock Chip 按钮,弹出对话框;
3、拉开芯片槽导轨,取出旧芯片 ;
4、把新芯片按箭头朝内方向插入,放平,推入芯片槽导轨;
5、点击对话框内的 Dock Chip 按钮;
6、确认缓冲液瓶中有足够的溶液;
7、点击 Tools—〉Prime,用缓冲液润洗整个管道系统。
四、样品的放取:
1、点击 Load Samples 图标;
2、待 Rack Locked 指示灯熄灭后,将样品盘轻轻提起取出;
3、将样品放入正确的位置:1-15 号可放置 1.5ml 标准 EP 管(必须剪去盖子,为防止溶液挥发,可加上 Biacore 专配的橡皮塞);H2O处放置专配的 4ml塑料管,每次实验前加入去离子水(切勿加盖),用于清洗进样针。
4、放回样品盘,点击 OK。
五、配体偶联:
1、配体预富集:蛋白用醋酸钠pH5.5,5.0,4.5,4.0分别稀释到10 ug/ml,各准备100ul通过预富集实验确定最适宜 pH条件;
2、配体偶联:点击 Other Options,在弹出的选项卡中选择 Wizards,打开预设实验模板。在 Open/New Wizard Template 的左边目标栏里点中 Immobilization 后双击打开。对话框中,在Chip type中选CM5,勾选Flow cell 2;method选用amine氨基偶联,ligand输入配体名称。可选用Aim for Immobilized level,Target level输入计算出的偶联量,或选用specify contact timeand flow rate,输入偶联时间。接着按Next,勾选prime。然后按照仪器给出的样品位置和样品量放置相应试剂和样品,点击Start。
六、样品检测:
1、配置运行缓冲液和溶剂校正曲线
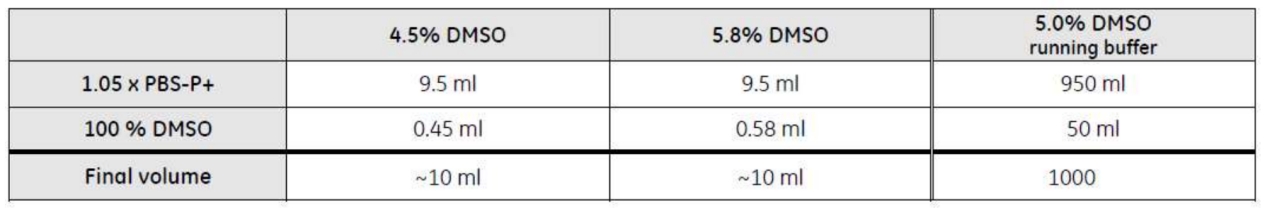
小分子样品的运行缓冲液选用含 5%DMSO 的 1×PBS-P+(视样品溶解性可调整 DMSO 含量,最高不超过 10%)
取 1.05 mL 10×PBS-P+用去离子水稀释到 1L,配成 1.05×PBS-P+。并按照下表,加入 DMSO,配置 5%DMSO 运行缓冲液和 4.5%、5.8%溶剂校正母液(running buffer 中 DMSO 浓度并非绝对 5%,可视小分子样品溶解度情况而定,0-10%均可。若 running buffer 中 DMSO 浓度变化,则溶剂校正母液也相应变化,只要 cover running buffer 中 DMSO 浓度即可)。
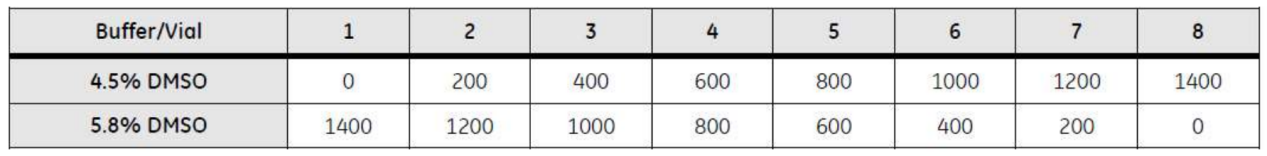
按照下表混合 4.5%和 5.8%母液配置 5%DMSO 浓度校正曲线(DMSO 标准液的数量并非一定要 8 个,通常 4-8 个均可。总体积也并非一定要 1.4ml,这些均可根据实际情况自行调整)
2、小分子样品准备
用不含 DMSO 的1.05×PBS-P+缓冲液稀释 10 mM 小分子母液 20
,得到 500 μM 含 5%DMSO 的1×PBS-P+中的小分子,再用配好的含 5% DMSO 的 Running Buffer 将分析物浓度稀释到 100 uM 作为最高进样浓度,向下对半稀释至少 5个浓度梯度,例如 100 μM, 50 μM, 25 μM, 12.5 μM, 6.25 μM, 3.125 μM(根据实际样品亲和力强弱进行浓度梯度调整)。间隔设置一个重复浓度,增加一个 0 浓度。
3、程序设置
(1)在Open/New Wizard Template 的左边目标栏里点中 Custom Assay Wizard 后双击打开。在 Custom Assay Wizard-System Preparation 界面,Flow cell 选择 1,2,同时勾选 Reference substration,Chip type 选择 CM5,Evaluation purpose 选择Kinetics/Affnity,将 prime before run 前的“√”去掉,点击 Next;
(2)在Cycle Definition 界面,点击 Cycle types 右侧的 new,新增一个循环,并点击Rename将分别将其命名为solvent correction 与analyte。选中Cycle types中的solvent correction 后,在左下方 Available 选项框中点击 Solvent correction,点击中间 Add 六次,增加六个溶剂矫正命令;
(3)选中Cycle types 中的 analyte 循环后,在左下方 Available 选项框中点击Sample,点击中间 Add,增加一个分析命令。点击 Selected 选项卡中的Sample1,在其右侧可以修改结合解离时间、流速等进样参数。本实验样品Contact time 修改为 60s, Dissociation time 为 120s,小分子通常无需再生。其他项无需修改。勾选 Extra wash,Extra wash 用 50% DMSO 清除管路中残留的小分子(extra wash 不流经芯片表面,不会影响配体活性)。点击两次Next;
(4)在Sample Table 界面,Concentration unit 选择 µM,点击 Add Row 增加循环。前三个循环 Cycle Type 为 analyte,Cycle purpose 为 Startup,Solution
称填入 PBS-P+。在实验浓度前后选择加入两个循环的溶剂校正Cycle Type与Cycle purpose 均选择 solvent correction。实验浓度部分 Cycle Type 为 analyte, Cycle purpose 为 Sample,Solution 填写样品名称,Conc 填写进样浓度(样品浓度由低到高填写)。注意要设置重复浓度和零浓度。具体填写如下:
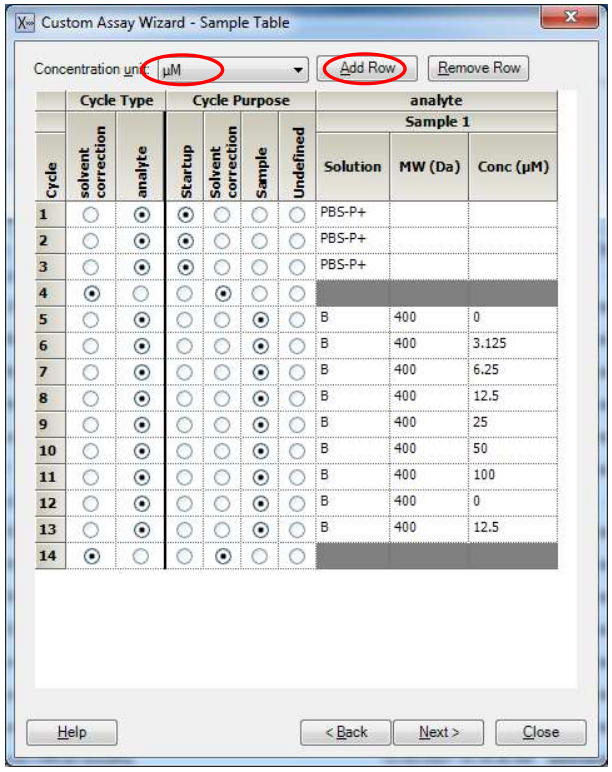
(5)点击 Next 进入 Kinetics/Affinity-Rack Position 界面,保持默认位置或自行通过鼠标拖拽到指定位置。若要合并相同样品,点开 Menu 后选 Automatic Positioning,pooling 选项选择 yes,点击 OK;
(6)点击 Load Samples,取出样品架,按照屏幕显示准备相应样品,放入样品体积略大于显示体积即可。盖好橡胶盖防止挥发,并按指定位置放置。放入样品架,点 Next 后,对方法进行保存,再对数据进行保存。点击start,仪器便会开始自动运行。
七、实验结果分析
1、打开分析软件 Biacore X100 Evaluation Software,点Data中open打开文件;
2、先点solvent correction进行溶剂校正分析。曲线要求落在-500到+1000RU,Chi2小于2;
3、小分子因亲和力较弱,多数没有动力学曲线,因此常选用用Afinity拟合。亲和力较强有动力学曲线的小分子可选用 kineties模型拟合;
4、选择要分析的样品,点Next,在included curves可以选择待分析的样品浓度;
5、点击左上角Fit可得到拟合结果,得知小分了与蛋白的亲和力。